【东大新闻网6月26日电】(通讯员 生萱)2023年6月22日,国际顶级学术期刊《Angewandte Chemie-International Edition》在线发表了东南大学数字医学工程全国重点实验室/生物科学与医学工程学院梁高林教授课题组的研究成果,文章标题为《Tandem Guest-Host-Receptor Recognitions Precisely Guide Ciprofloxacin to Eliminate Intracellular Staphylococcus aureus》。该项研究基于前期CBT-Cys点击反应的研究基础,首次提出了一种客体-主体-配体串联识别的策略(Tandem Guest-Host-Receptor Recognitions),引导环丙沙星在感染的巨噬细胞内精准递送、智能组装及响应性释放,从而实现胞内金黄色葡萄球菌的高效清除。(Angew. Chem., Int. Ed.2022, DOI: 10.1002/anie.202306427)。
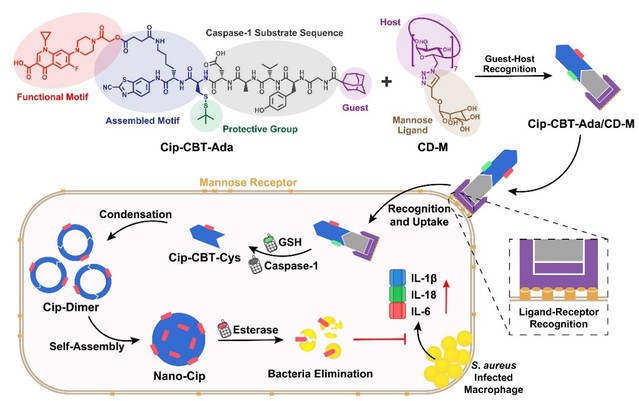
细胞内隐匿的金黄色葡萄球菌与多种严重(甚至致命)的感染疾病相关,如皮肤和软组织感染、肺炎、败血症和心内膜炎等。抗生素是目前临床上治疗细胞内金黄色葡萄球菌感染的首选。然而,由于宿主细胞的细胞膜屏障和外排泵等的存在,直接使用抗生素的治疗效果往往不佳,并且容易产生耐药。针对这一难题,东南大学梁高林教授团队合成了一种环丙沙星-多肽偶联分子Cip-CBT-Ada(见上图)。该分子由以下几个部分组成:1)抗生素环丙沙星;2)CBT和StBu保护的Cys,用于CBT-Cys点击反应;3)半胱氨酸蛋白酶-1(Caspase-1,一种感染过程中过度表达的酶)特异性识别的多肽底物YVAD;4)客体分子金刚烷(Ada)。首先,作者通过紫外-可见滴定实验,验证了Cip-CBT-Ada可以通过客体-主体识别作用与甘露糖七取代的β-环糊精(CD-M)结合形成超分子Cip-CBT-Ada/CD-M。细胞实验表明,Cip-CBT-Ada/CD-M可以利用环糊精上的局部高甘露糖密度,通过多价态配体-受体识别作用特异性靶向巨噬细胞。接着,Cip-CBT-Ada/CD-M在胞内Caspase-1和谷胱甘肽的激活下,发生CBT-Cys点击反应生成环状二聚体Cip-Dimer并进一步原位自组装形成环丙沙星纳米粒子Nano-Cip。最终,环丙沙星纳米粒子Nano-Cip在酯酶的作用下持续、缓慢释放环丙沙星,从而高效杀灭胞内金黄色葡萄球菌。作者通过体内外实验证实了,与游离环丙沙星和Cip-CBT-Ada单体相比,超分子Cip-CBT-Ada/CD-M具有更强的胞内细菌清除和炎症治疗的能力。该工作为胞内细菌感染的抗生素治疗提供了一种新的思路和策略。
该论文共同第一作者是东南大学副研究员占文俊博士、博士生徐玲玲和硕士生刘智宇。通讯作者为东南大学首席教授/数字医学工程全国重点实验室副主任梁高林教授。该研究得到了科技部重点研发计划,国家自然科学基金重点项目和青年科学基金项目的资助。
附文章链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202306427
供稿:生物科学与医学工程学院

